진원생명과학은 “미국 FDA와 코로나19 백신인 GLS-5310의 미국 임상 1상에 대한 pre-IND 절차를 마치고, 임상 승인 신청을 완료했다”고 19일 밝혔다.
진원생명과학은 “미국 임상연구를 통해 GLS-5310의 피내 접종과 비강 내 스프레이 투여를 병용하여 효능을 평가한 후, 후기 임상연구를 위한 최적 백신 접종조건 선정에 활용할 계획”이라고 말했다.
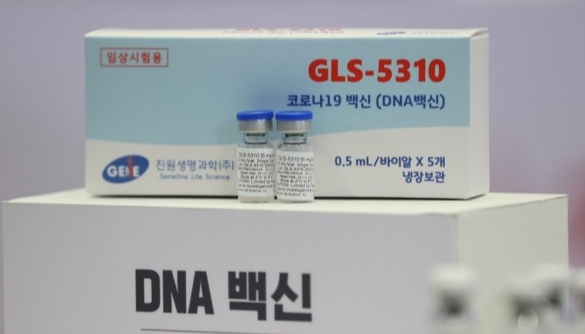
현재 국내에서는 GLS-5310는 1/2a상 임상승인을 받고, 고려구로병원 감염내과(김우주 교수)에서 피내 투여에 관해 임상 진행 중에 있다.
국내외 연구결과에 따르면, 비강 내 백신 투여는 점막 IgA 면역반응을 유도하여, 코로나19 바이러스의 최초 진입 부위인 코 부위 감염을 억제한다. 또한, 코 부위의 바이러스 감염은 다른 사람에게 전파되어 감염을 유발할 수 있기 때문에 백신에 의한 코 부위 감염을 동시에 억제하면 이상적인 백신의 효능을 기대할 수 있다.
진원생명과학은 “토끼를 이용한 동물실험 결과, GLS-5310의 피내 접종만으로도 IgA 항체 생성을 유도했지만, 비강내 투여와 피내 접종을 병행한 결과, 다량의 IgA 항체 생성을 확인했다”고 설명했다.
박영근 진원생명과학 대표이사는 “우리 회사는 코로나19 감염병에 대응하는 견고한 제품군을 갖추고 있다”며 “코로나19 백신인 GLS-5310은 국내는 물론 미국에서도 임상이 진행될 예정이다.
한편 코로나19 바이러스 감염방지 코 스프레이 치료제인 GLS-1200은 미국에서 2상 임상연구를 진행하고 있다. GLS-1200은 족제비 감염동물모델 평가를 통해 제작됐다. 그리고 중증 코로나19 감염증을 유발하는 사이토카인 폭풍을 억제하는 면역조절 의약품으로 GLS-1027도 미국에서 2상임상연구 승인을 받아 개발하고 있다”고 밝혔다.
<저작권자 ⓒ 한국건강신문, 무단 전재 및 재배포 금지>
- 김상은 기자
[email protected] - 다른기사보기