허가전담심사팀 구성
신종 코로나 바이러스 감염증, 코로나19 백신과 치료제에 대한 허가심사 기간이 대폭 줄어든다.
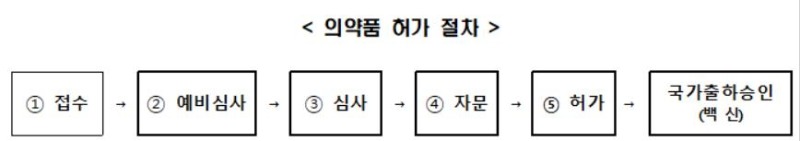
식품의약품안전처는 27일 국내·외에서 개발 중인 코로나19 백신 및 치료제의 허가심사 기간을 기존 180일에서 단축해 40일 이내에 처리하는 것을 목표로 하고 있다고 밝혔다.
현재 식약처는 해외 제약사 아스트라제네카, 얀센(존슨앤드존슨), 화이자의 백신에 대한 사전검토를 진행하고 있다.

국내 항체치료제 개발 업체인 셀트리온의 경우 이달 중 사용승인을 신청할 예정이라고 밝힌 상태다.
이에따라 코로나19 백신의 경우 통상 2∼3개월 이상인 기존 국가출하승인 처리기간 역시 단축해 20일 이내에 처리하는 것을 목표로 추진할 계획이다.
이달 25일 기준 화이자 백신은 미국, 영국 등 8개국에서 긴급사용승인을 받았고 유럽연합과 스위스에서는 조건부 허가를 받은 상태다. 모더나 백신은 미국에서 긴급사용승인을 받았다.
국내에서는 현재 5개 백신이 임상 중이지만, 대부분 초기 단계인 1상이나 1/2상 단계에 있다.
치료제의 경우 다국적 제약사 릴리, 리제네론에서 항체치료제 임상 3상이 진행 중이며, 미국에서 긴급사용승인을 받았다.
국내에서는 새로운 코로나19 치료제로 개발 중인 항체치료제 등 총 15개 제품(13개 성분)이 임상 중이다.
<저작권자 ⓒ 한국건강신문, 무단 전재 및 재배포 금지>
- 김선애 기자
[email protected] - 다른기사보기